
《肿瘤》

纳米酶是一类自身蕴含酶学特性的纳米材料,如同天然酶一样,能够在温和条件下催化酶的底物,呈现出与天然酶相同的酶促反应动力学和反应机制,并可作为天然酶的替代物应用于疾病检测。近几年,研究者发现纳米酶蕴含的氧化还原酶活性可以调节细胞中活性氧,如催化肿瘤部位的H2O2产生羟基自由基,从而引起肿瘤细胞的凋亡,然而,由于肿瘤部位H2O2浓度有限而且纳米酶与底物H2O2的亲和力较低,产生的羟基自由基通常不足以有效治疗肿瘤。纳米酶的肿瘤治疗应用目前面临两个挑战:一是如何提升纳米酶与底物H2O2的亲和力;二是如何提高肿瘤细胞中H2O2的浓度。
3月12日,ACS Nano在线发表了中国科学院院士、中科院生物物理研究所/纳米酶工程实验室研究员阎锡蕴团队的最新研究成果。研究人员设计出一种新型纳米酶,即硫铁矿(FeS2)纳米酶。研究者发现,这种纳米酶结合H2O2底物的亲和力极高,催化H2O2的效率(kcat/KM)比传统Fe3O4纳米酶高4144倍,比天然辣根过氧化物酶高3086倍。使用第一性原理计算方法探究原因发现,与传统的Fe3O4纳米酶相比,硫铁矿(FeS2)纳米酶与底物H2O2相互作用时配位结合的共价键更短,而且表面含有很多沟壑状结构,使其与底物的结合能力更强,因此能够催化肿瘤部位有限的H2O2,产生大量的羟基自由基,引起肿瘤细胞的凋亡。
硫铁矿纳米酶不仅对H2O2有很高的亲和力, 而且还能够自身产生H2O2。这是由于硫铁矿纳米酶同时还具有谷胱甘肽氧化酶的活性,可以氧化细胞中的还原型谷胱甘肽(GSH)生成H2O2,生成的H2O2又可作为过氧化物酶的底物。因此,硫铁矿纳米酶蕴含的两种类酶效应,谷胱甘肽氧化酶和过氧化物酶,构成自级联反应,能够持续地产生羟基自由基,引起更多肿瘤细胞的凋亡。此外,谷胱甘肽氧化酶活性还会引起GSH的消耗,而GSH是膜脂修复酶--谷胱甘肽过氧化物酶 4的辅因子,其耗竭会导致后者的失活,使得细胞中的脂质过氧化物不能被有效清除,引起细胞的铁死亡。
硫铁矿纳米酶同时引起肿瘤细胞凋亡和铁死亡的特性,使其在含有KRAS突变的、凋亡抗性的耐药肿瘤细胞中,依然表现出高效的肿瘤治疗效果。另外,研究者对硫铁矿纳米酶的生物安全性研究发现,其细胞杀伤效果具有肿瘤特异性,这主要是因为肿瘤细胞比正常细胞代谢更加旺盛,产生更多的H2O2,使纳米酶催化产生更多的羟基自由基;而且肿瘤细胞需要更多GSH来维持氧化还原平衡,因此对GSH耗竭更敏感;同时,肿瘤细胞的快速生长需要更多铁离子,更容易发生铁死亡。此外,硫铁矿纳米酶具有良好的生物降解性,肿瘤特异性杀伤效果和生物降解性为它的体内应用提供了安全性保障。
高活性的硫铁矿纳米酶克服了传统过氧化物纳米酶对H2O2亲和力低的问题,能够催化肿瘤部位有限的H2O2产生大量的羟基自由基。同时,硫铁矿纳米酶的新活性--谷胱甘肽氧化酶活性的发现,不仅能为其过氧化物酶活性的发挥提供底物H2O2,且能催化氧化谷胱甘肽,引起细胞铁死亡,从而实现肿瘤的凋亡-铁死亡协同治疗。重要的是,硫铁矿纳米酶无需其他任何帮助,单一材料即可实现高效、安全的肿瘤治疗效果,表明其具有较大的临床转化潜力。
研究工作由生物物理所、扬州大学和深圳市第二人民医院合作完成,深圳市第二人民医院教授聂国辉,生物物理所阎锡蕴、研究员高利增和范克龙为论文通讯作者。博士生孟祥芹、李丹丹为论文共同第一作者。研究工作得到国家重点研发计划、国家自然科学基金、中科院创新交叉团队项目和中科院青年促进会等的资助。
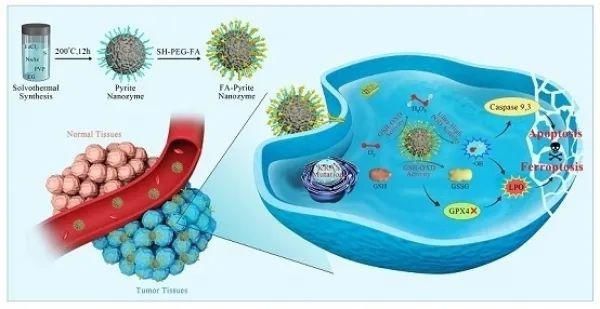
高效-自级联的硫铁矿纳米酶用于肿瘤的凋亡-铁死亡协同治疗示意图
来源:中国科学院生物物理研究所
【来源:中科院之声】
声明:转载此文是出于传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 邮箱地?/p>
上一篇:癌症治疗新篇章,不使用化疗也能有效控制肿瘤
下一篇:没有了