
《肿瘤》

“宿主的内环境之于肿瘤细胞,就好比生态环境之于生物个体。”近日,中科院院士、我院院长宋尔卫课题组在著名学术期刊《自然·癌症》发表重磅论文,提出“肿瘤生态学”的核心概念。
从探索乳腺癌的根治性保乳术开始,宋尔卫团队关注肿瘤与肿瘤微环境的关系,率先提出乳腺癌保乳手术后,可对肿瘤微环境进行“改造”,联合免疫治疗等手段来改善乳腺癌的治疗效果。
他们进一步深入研究发现,肿瘤不仅与周围的微环境发生关系,也会与远处乃至全身的器官组织微环境,以及神经、内分泌和免疫系统等发生相互作用。这些相互作用,决定了肿瘤的发生发展及对其治疗的敏感性。这便是肿瘤生态学的核心观点。
一脚踏入肿瘤生态学的“处女地”,宋尔卫团队经过十几年的探索,从临床到基础研究,如今形成了完整的学科体系。围绕这一新兴学科,研究者将可以开发出更精准的癌症诊断方法,并针对一系列新靶点,研发出更多抗癌药物及细胞治疗方案等。

中科院院士、我院院长宋尔卫教授
肿瘤微环境:保器官手术生存率更高的秘密
2020年,乳腺癌新增人数达226万,取代肺癌,成为全球最常见癌症。在中国,乳腺癌发病仍在快速上升。
人类与乳腺癌的斗争由来已久。19世纪末期,“大块切除”的乳腺癌根治术被提出。这种手术不仅要将肿瘤边缘5厘米的组织都切除,还要清扫所有的腋窝区域回流淋巴结,以“斩草除根”。
但这一术式创伤较大,并发症多,效果也不见得好。当时,乳腺癌五年生存率不过50%左右。
这是因为,在乳腺癌被发现之前,往往就已经有少量的乳腺癌细胞脱落,随着血液和淋巴液播散到全身。即使肿瘤被切除,这些在远处“潜伏”的癌细胞也会复发转移。
原位乳腺癌并不致命,但一旦癌细胞转移到肝、肺、脑等其他重要器官,就可能危及生命了。因此,如何防止乳腺癌转移复发,成为对抗乳腺癌的关键课题。
上世纪60-80年代,在国际上,缩小手术范围并配合放化疗等综合治疗手段的保乳术逐渐兴起。多次临床试验均证明,保乳术对病人生存获益与全切术相当。要知道,当时放化疗及内分泌等治疗手段都比较落后,保乳术都能有这么好的效果,潜力巨大。
自1990年代开始,刚硕士毕业的宋尔卫与著名乳腺癌专家苏逢锡教授在国内最早探索乳腺癌的保乳手术。这一项极具前景的探索却受到了当时很多外科医生的反对。
宋尔卫说,当时在国内,恶性肿瘤大块切除的理念仍深入人心,保乳术被认为切除得不彻底,容易复发转移。

但他们坚持了下来。近10年来,通过回顾性分析发现,在我院接受保乳术的患者十年生存率高于同期的全切患者,达到了欧美顶尖乳腺肿瘤中心水平的91%。2019年,我院的早期乳腺癌患者保乳率达到了51.7%,术后年复发率小于1%,居全国领先水平。
为何保乳术加上放化疗等辅助治疗,效果会比全切更好?背后的科学原理是什么?宋尔卫团队独辟蹊径,对切除肿瘤后残留的肿瘤微环境开展了研究。
他们解释说,如果将肿瘤比作“种子”,肿瘤微环境就是种子生长所依赖的“土壤”。肿瘤切除后,对保留的微环境“土壤”进行“改造”,例如放化疗、内分泌治疗、靶向治疗、免疫治疗等,能够激发和调动抗肿瘤的免疫机制,杀死残余的肿瘤细胞,还能控制肿瘤的全身扩散和转移、复发。
其实,这样的情况不仅发生在乳腺癌。大量临床实践发现,在保乳手术、保膀胱肿瘤切除术、非规则肝切除等保留器官的肿瘤切除术后,留存的器官往往能发挥“土壤”的作用,激发抗肿瘤免疫机制。
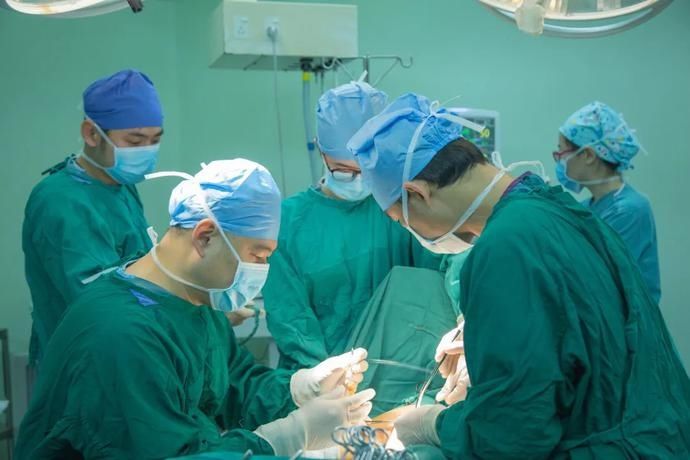
宋尔卫院士(左二)开展手术
全身内环境:解开肿瘤转移、耐药谜团
其实,与肿瘤细胞“互动频繁”的,岂止肿瘤微环境。
最明显的例子是全身免疫系统。人体每天都会有肿瘤细胞产生,但免疫系统具有监控能力,会识别并摧毁它们。
肿瘤细胞会想出各种办法逃离免疫监视。当免疫系统逐渐无法控制肿瘤细胞的生长,平衡被打破,肿瘤就会迅速发展、失控。
“占了上风”的肿瘤分泌出很多免疫抑制因子,或“招募”一些能抑制免疫反应的细胞,营造出一个有利于自身生存发展的免疫抑制生态环境。
上一篇:肿瘤家属如何和病人沟通病情?
下一篇:没有了