
《肿瘤》

2021年2月份发表在Nature Cancer(Nature旗下新期刊,无影响因子)上的关于GBM异质性的单细胞研究,Gradient of Developmental and Injury Response transcriptional states defines functional vulnerabilities underpinning glioblastoma heterogeneity。该研究从肿瘤干细胞的角度出发,刻画了两个主要存在的细胞状态:发育、损伤应答,并且联合原位GBM的单细胞数据进一步验证了这两种状态的存在。作者认为胶质母细胞瘤生长于基于GSCs(胶质母细胞瘤干细胞,Glioblastoma Stem Cells)的神经创伤反应转录程序中,这是一个很有前途的治疗开发的新靶点。文中使用了许多单细胞分析的经典方法,包括识别细胞亚群、刻画细胞状态、推断CNV、轨迹分析等,如果您感兴趣可以自行查看方法部分,您也可以在留言区进行评论,我们根据整体的留言情况后期介绍相关的技术或分析方法。

图0 文章信息
背景:
胶质母细胞瘤(GBM)是脑部肿瘤当中侵袭性最强、治疗抵抗的恶性肿瘤,治疗失败的根源在于肿瘤内部和患者之间广泛存在的异质性。单细胞RNA测序的研究已经突出了GBM复杂的生物学机制,GBM表型多样性和可塑性的潜在来源可能是稀有的自我更新的胶质母细胞瘤肿瘤干细胞部分(GSCs,Glioblastoma Stem Cells)。GSCs劫持发育性干细胞程序,以驱动和维持肿瘤生长,并获得耐药性机制以逃避化疗和放疗。目前尚不清楚多样性的GSCs如何影响GBM的细胞组成和生长。
数据及代码:
数据: 。scRNA-seq, snRNA-seq数据。
代码:
主要发现:
1. GSCs的转录组异质性的初步刻画
作者利用无血清的培养方法从体外培养GSCs,来自26个患者的累计29个早期传代(21个adherent和8个neurosphere),选择个细胞进行单细胞测序。对每个患者的细胞表达谱进行亚群分析,发现每个患者具有2-6个clusters,29个样本共计86个clusters。紧接着,作者利用scRNA-seq数据推断拷贝数,结果发现7号染色体扩增及10号染色体缺失在clustes中是常见的,这表明这些可能是克隆的,涉及到神经干细胞恶性转化为GSCs的事件。例如,样本G876_L中3个clusters都具有7号染色体的扩增,但C1和C2的9号染色体扩增,C3的12号染色体扩增。此外,另外一个样本的两个clusters则具有相同的CNV模式。以上结果表明,尽管CNV是GSCs异质性clusters中很常见,但是CNV只是驱动了瘤内异质性的一部分。
此外,作者还利用UMAP刻画了瘤间的异质性,发现患者之间的异质性很强,在未经校正的情况下,GSCs按照患者或样本的属性进行聚类。此外,作者采用了多种批次校正的方法后,并比较了不同方法的结果,进行重新聚类。
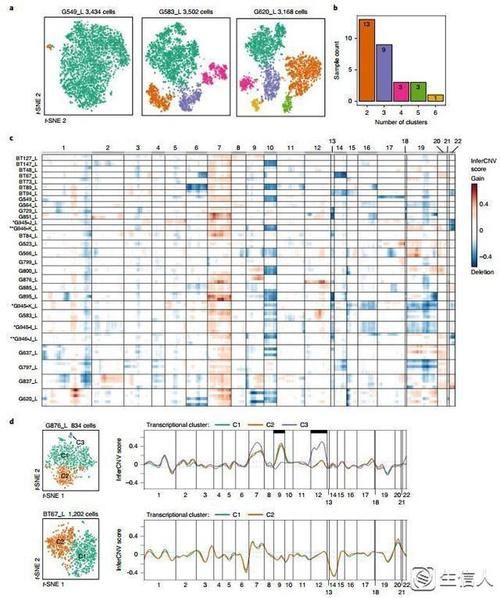
图1 刻画GSCs的异质性
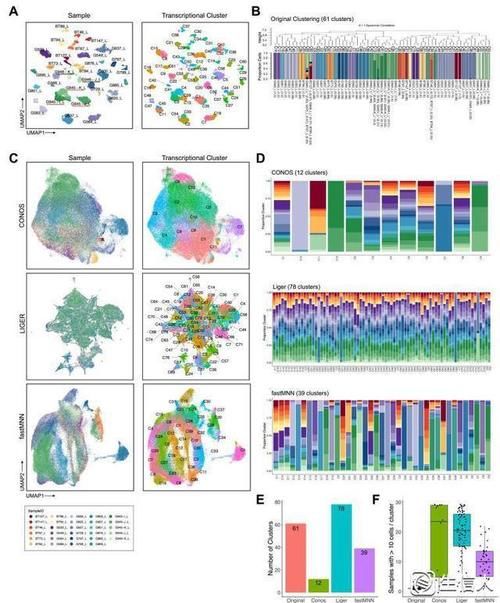
图2 所有患者GSCs间的聚类关系和批修正方法的评估
2. GSCs的异质性是一个转录组渐变的过程(梯度)
主成分分析显示PC1将所有细胞分为两个主要的亚群。PC1得分高的细胞与间充质相关基因的表达升高、炎症和免疫细胞激活、以及核因子(NF)-κB和STAT信号通路相关,并且这些基因也是在TCGA间充质亚型中富集。PC1得分低的细胞与胶质细胞发生、神经发育过程相关。对于每个患者,GSCs在发育和损伤反应谱中占据一个离散的范围。(“高端的食材往往需要最朴素的烹饪方式”,有时候最简单的方法往往能揭示最朴素的现象)
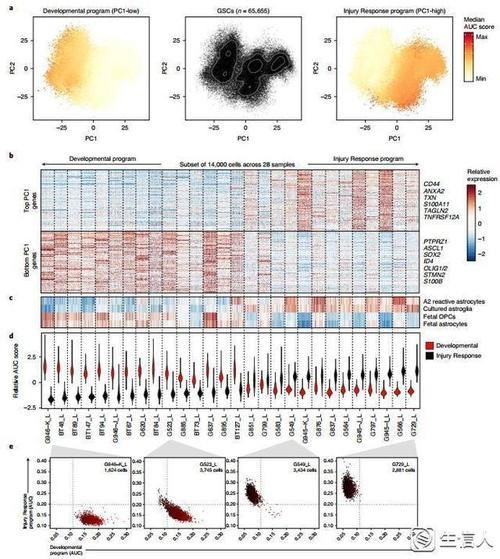
图3 GSCs在发育和损伤反应状态之间集中在一个转录梯度上
3. GSCs的发育和损伤反应具有功能差异和可塑性
作者使用体外限制稀释法来解读GSCs的自我更新过程,我们发现与损伤反应GSCs相比,发育性GSCs具有更高的球形细胞形成率。将这两种状态的GSCs分别植入累计37个小鼠当中,发现两组小鼠并不存在生存方面的区别。此外,将发育性GSCs用炎性细胞因子处理,48h之后通过RT-qPCR发现细胞出现了损伤应答基因的表达,表明了GSCs可以被微环境因素诱导。
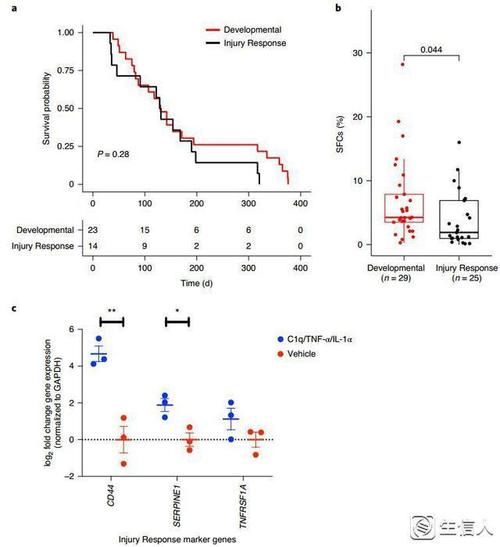
图4 GSCs的发育和损伤反应具有功能差异和可塑性潜力
4. 全基因组CRISPR筛选反映了发育-损伤反应梯度位置
作者选取了11个样本进行CRISPR–Cas9实验,无论在梯度上的位置如何,所有GSCs都拥有来自两端的必要基因,这表明在GSCs中发育和损伤反应过程必要基因组合靶向作用,可能对患者有治疗益处(本结果从实验层面证实了生信层面单细胞分析的结果,此处不再赘述)。
上一篇:北京基因组所等揭示肿瘤相关巨噬细胞调控CD8+
下一篇:没有了